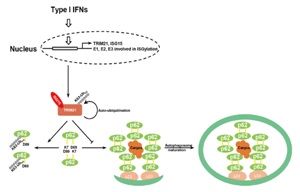
干扰素刺激基因15(ISG15)是类泛素蛋白,可以对目标蛋白进行共价修饰,称为蛋白的ISGylation。与泛素化修饰(ubiquitination)类似,活化酶E1、偶联酶E2和连接酶E3参与了蛋白的ISGylation。应用蛋白组学技术已鉴定到数百个可能发生ISGylation的底物蛋白,但ISGylation的生物学功能仍有待进一步阐明。2021年7月13日,邓海腾课题组在Cell Death & Disease杂志发表了题目为“Induced TRIM21 ISGylation by IFN-β enhances p62ubiquitination to prevent its autophagosome targeting”的研究论文。该研究利用生物质谱技术结合分子生物学和生物化学等方法揭示了TRIM21发生ISGylation的位点,发现TRIM21的ISGylation影响TRIM21作为泛素化E3连接酶的活性。
该研究工作发现TRIM21发生I型干扰素介导的ISGylation,而HERC5是TRIM21进行ISGylation的E3连接酶,而USP18催化去ISGylation;生物质谱分析揭示Lys260和Lys279是TRIM21上ISGylation的主要修饰位点。TRIM21上的ISGylation特异性地增强其催化K63连接的多聚泛素化的E3连接酶活性,并且增强了TRIM21自身以及它的底物p62上K63连接的多聚泛素化水平,从而抑制p62的自身寡聚化以及p62与自噬小体的融合。
清华大学生命科学学院博士生金杰为该文的第一作者,教育部生物信息学重点实验室的邓海腾为该文的通讯作者,该课题组已毕业的博士生霍祎和清华大学蛋白质技术中心蛋白质化学和组学平台的孟献斌参与该项研究。该研究获得了国家自然科学基金委和科技部重点研发项目的资助。