哺乳动物生命起始于终末分化的精子和卵子通过受精过程形成一个全能性的受精卵。受精卵最初处于全基因组转录沉默状态。不同哺乳动物经过一或几轮细胞分裂后,受精卵开始发生第一次转录事件称为合子基因组激活(Zygotic genome activation,ZGA)。ZGA发生后,随着胚胎发育的进行,出现第一次谱系分化从而形成内细胞团(ICM)和外胚层(TE)。ICM随后发育形成具有Nanog表达的外胚层(Epi)和Gata6表达的原始内胚层(PrE)。在体外,ICM可以诱导获得胚胎干细胞,胚胎干细胞以及诱导多能干细胞的转录调控网络可以一定程度上反映多能性建立和维持的过程。例如核心多能性转录因子NANOG、SOX2和OCT4共同调控多能性的转录网络。然而迄今为止,在体内,ZGA如何与哺乳动物胚胎的第一次谱系分化相连接以及胚胎的多能性如何建立仍然不清楚。
清华大学生命学院颉伟研究组于2023年11月7日在《细胞研究》(Cell Research)期刊上以长文形式报道了题为《NR5A2在全能性胚胎中连接合子基因组激活与第一次谱系分化》(NR5A2 connects zygotic genome activation to the first lineage segregation in totipotent embryos)的研究论文,揭示了转录因子是如何连接受精卵的合子基因组激活与第一次谱系分化。这一重要发现阐明了早期胚胎发育全能性向多能性转换的功能与机制。
NR5A2是一个核受体家族转录因子。颉伟课题组前期研究表明发现NR5A2在ZGA过程中被激活,并且其DNA结合基序也在2-8细胞时期胚胎开放染色质中呈现明显富集。在本研究中,研究人员通过对Nr5a2的敲低和敲除实验发现,这些胚胎会呈现桑椹胚时期(16细胞)阻滞。对Nr5a2敲降的胚胎进行转录组分析发现,4-8细胞时期特异激活的基因受到影响,但对全局的ZGA发生影响则十分有限。随后,研究人员使用CUT&RUN以及ATAC-seq技术发现,1)NR5A2结合在2和8细胞的顺式调控元件(cis-regulatory elements)上,且激活2-8细胞时期的基因表达;2)NR5A2结合位点富集大量的B1重复元件,这些重复元件上含有大量的OBOX,NR5A2,RARG等早期胚胎发育重要的转录因子结合基序;3)NR5A2对2细胞时期染色质开放影响不大,但对8细胞时期特异的染色质开放则至关重要。很多这些位点在胚胎发育后期或者胚胎干细胞时期会被NANOG,SOX2,OCT4等多能因子结合。重要的是,NR5A2在8细胞时期激活了关键的多能性基因Nanog和Oct4,以及与胚胎外胚层和原始内胚层调控相关的关键基因如Tead4,Gata3和Gata6。综上所述,该研究发现并深入研究了NR5A2在胚胎中连接ZGA与第一次谱系分化中作用的分子机制,揭示了转录因子在早期胚胎发育过程中的重要功能。
颉伟教授为本文的通讯作者,清华大学生命学院赖方秾博士(已毕业)、李丽佳博士(已毕业)、2019级博士生胡晓瑜以及博士后刘伯峰为共同第一作者。合作实验室包括中科院生物物理所邓红雨教授和田华彬博士、中科院分子细胞科学卓越创新中心李劲松教授和李庆博士。清华大学生命学院2021级博士生朱子奇、颉伟课题组科研助理刘玲也在该课题中做出重要贡献。该课题得到了清华大学实验动物中心,生物医学测试中心基因测序平台以及计算平台的大力协助和支持。刘伯峰获得了清华大学水木学者计划支持,本研究获得了国家自然科学基金会、国家科技部重点研发计划、清华-北京生命科学中心的经费支持。颉伟教授是HHMI国际研究学者和新基石研究员。
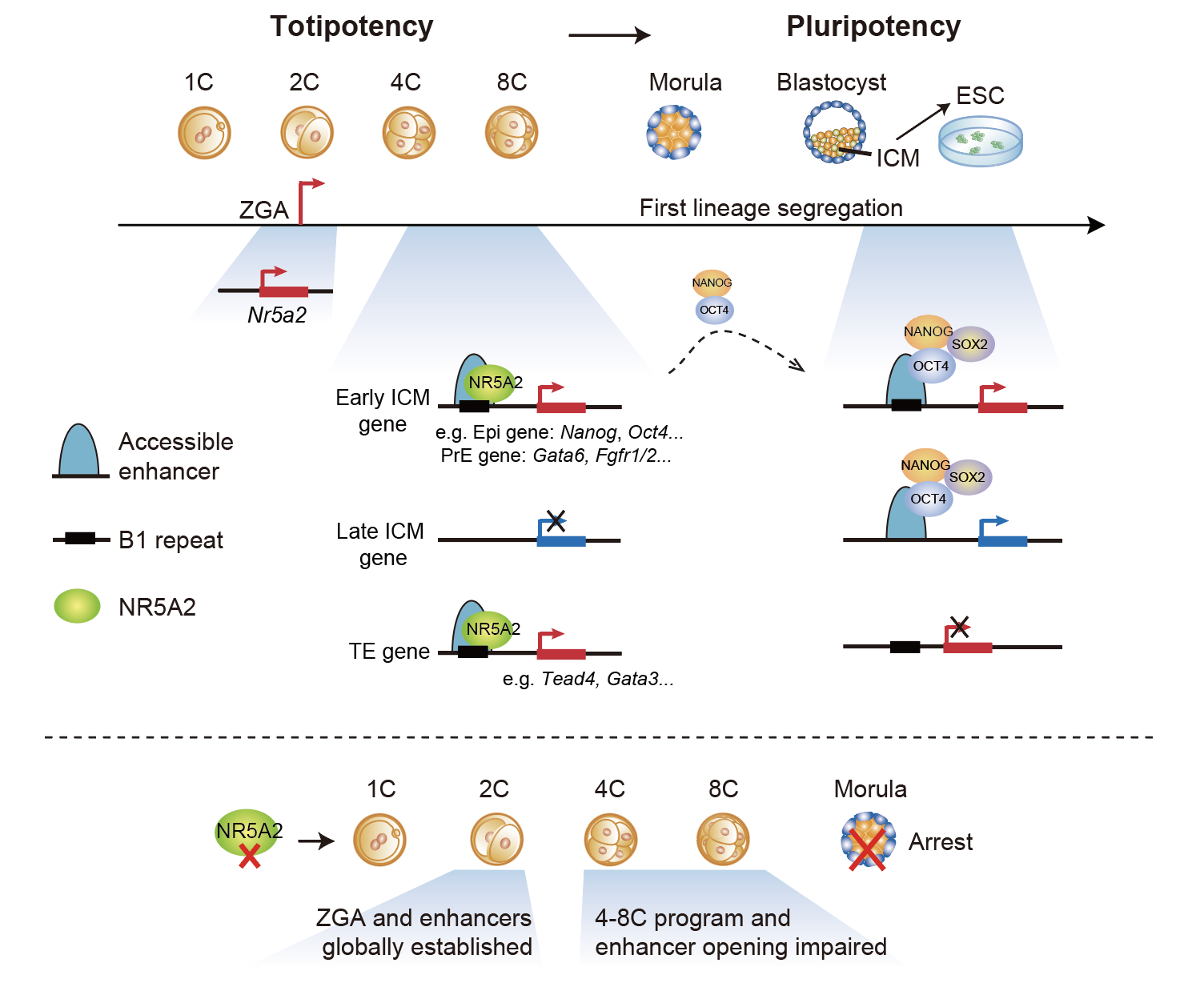
图1. NR5A2在早期胚胎发育中连接基因组激活与第一次细胞命运决定